ENNONCE
Partie A : Évaluation des ressources : 24 points
Exercice I : Vérification des savoirs : 8 points
l. Définir : couple acide-base ; teinte sensible d'un indicateur coloré 1 pt
2. Choisir la réponse juste :
2- l -Une cétone est obtenue par oxydation ménagée d'un alcool ;
a) Primaire ;
b) Secondaire ;
c) tertiaire.
2-2. La présence du doublet libre sur l'atome d'azote dans la structure des amines leur confère un caractère
a) acide
b) neutre
c) basique. 0,5pt
Nommer l’ion dipolaire électriquement neutre obtenu par transfert d'un proton dans une molécule d'un acide alpha aminé 1pt
5. Écrire la formule générale des amides NN-disubstitués. 1 pt
6. Donner deux caractéristiques de la réaction entre un acide carboxylique et un alcool. 1 pt
6- Donner un facteur cinétique et dire comment il influence la vitesse de formation d'un produit. 2 pt
Exercice 2 : Application des savoirs : 8 points
l. Écrire les formules semi-développées des composés suivants :
i) N-rnéthylproponamide ;
ii) 2-méthylbutanoate de 1-méthypropyle 2 pts
2. Par oxydation ménagée d'un composé organique A. on obtient un composé B qui donne un précipité jaune avec la 2.4- DNPH, et fait rosir le réactif de Schiff.
2- l -Donner la nature de chacun des corps B et A. 1 pt
2-2-On ajoute à B une solution de dichromate de potassium en milieu acide, la solution devient verte et on obtient l'acide 2-méthylpropanoïque. Ecrire les formules semi-développées de A et B. 2 pts
3- Une solution d'acide benzoïque \({C_6}{H_5}COOH\) de concentration \(C = {10^{ - 2}}\) moL/L a un pH égal à 3,2 à 25°C.
3-l- Montrer que l'acide benzoïque est un acide faible. 1 pt
3-2- Écrire l'équation-bilan de sa réaction avec l'eau. 1 pt
3-3- Écrire l'expression de sa constante d'acidité Ka en l'onction des concentrations des espèces présentes en solution. 1 pt
Exercice 3 : Utilisation des savoirs : 8 points
l. A l'instant t = 0, on mélange dans un bécher une solution aqueuse d‘iodure de potassium
\(\left( {{K^ + } + {I^ - }} \right)\) et une solution aqueuse de peroxodisulfate d'ammonium \(\left( {2NH_4^ + + S2O_8^{2 - }} \right)\). Il se produit une réaction lente.
L'équation-bilan de in réaction qui n lieu est :
\(2{I^ - } + {S_2}O_8^{2 - }\) \( \to \) \({I_2} + 2SO_4^{2 - }\)
Dans ce mélange maintenu à 25°C, on effectue des prélèvements réguliers à des dates différentes afin de déterminer par dosage la concentration du diode formé \({I_2}\) .
Le tableau suivant donne la concentration du diiode dans les différents prélèvements en fonction de temps t.
| t(min) | 0 | 2,5 | 5 | 10 | 15 | 20 | 25 | 30 |
| \(\left[ {{I_2}} \right]\) \({10^{ - 2}}\) mol/L | 0 | 0, 95 | 1, 70 | 2, 95 | 3, 85 | 4, 57 | 5, 15 | 5, 00 |
l-l- Représenter sur le papier millimétré de la page J sur 3 la courbe \(\left[ {{I_2}} \right] = f(t)\). 2 pt
Échelle : 2 cm pour 5 min et 2 cm pour \({10^{ - 2}}\) mol/L
l-2- Déterminer en mol/L.min la vitesse de formation de \({{I_2}}\) à t = 15min 2 pts
1-3- Écrire la relation entre la vitesse de formation de \({{I_2}}\) et la vitesse de disparition de \({I^ - }\) puis en déduire la vitesse de disparition de \({I^ - }\) à t = l5min. 2 pt
2. Dire comment varie la vitesse de formation du diiode au cours du temps. 1 pt
3. Pour doser la solution de diiode à différentes dates, les prélèvements ont été placés dans un bain de glace. Justifier cette opération. 1 pt
Partie B: Évaluation des compétences : / 16 points
L'amicale des anciens élèves du collège Bilingue "LES COMPETENTS" a fait un don en matériel de chimie à leur ancien établissement. Parmi ce matériel se trouve un pH mètre.
Nécessitant le mode de fabrication d'une solution de pH connu qui servira de vérifier le bon fonctionnement de l'appareil avant son utilisation, le principal du collège adresse à l'établissement le plus proche la commande suivante :
« Besoin urgent d’un protocole pour fabrication de 150 mL d’une solution tampon de pH- 9,2 afin de vérifier le bon fonctionnement de notre pH- mètre nouvellement offert par notre chère amicale »
ATEBA élève de terminale D. est intéressé par la préoccupation du principal. Pour cela il se rend au laboratoire du Lycée et se met à l'œuvre.
Les solutions (avec leur concentration), la verrerie et le matériel disponibles au laboratoire sont consignés dans le tableau suivant :
Solutions
• Acide chlorhydrique : \({C_1} = 0,1\) moL/L
• Hydroxyde de sodium : \({C_1} = 5 \times {10^{ - 2}}\) moL/L
• Ammoniac : \({C_3} = 0,1\) moL/L
• Acide éthanoïque : \({C_4} = 5 \times {10^{ - 2}}\) moL/L
• Eau distillée
Verrerie et matériel
• Burettes
• Erlenmeyers
• Béchers
• pH-mètre
• Agitateurs magnétiques
• Potences
• Barreaux aimantés
• Pissettes d'eau
Données : \(pKa(C{H_3}COOH/\) \(C{H_3}CO{O^ - }) = 4,8\) et \(pKa(NH_4^ + /\) \(N{H_3}) = 9,2\)
1. Propose un protocole qui permet d'aboutir au point de demi-équivalence en utilisant un acide faible AH, une base forte \(H{O^ - }\) et un pli-mètre. 8 pts
Tu t'aideras d ‘un dispositif expérimental.
2. A partir d'un choix judicieux des réactifs parmi ceux disponibles au laboratoire, réponds au besoin de la commande tout en précisant les volumes à utiliser. 8 pts
CORRECTION
Partie A : Évaluation des Ressources / 24 points
Exercice 1 : Vérification des savoirs / 8 points
1. Couple acide base : Ensemble constitué de deux espèces acide et base tous conjugués. 1 pt
Teinte sensible : couleur prise par un indicateur coloré dans sa zone de virage.
2. QCM :
2.1 : b (alcool secondaire) ; 0,5 pt
2.2 : c (basique) 0,5 pt
3. Amphion ou Zwitterion 1 pt
4. Formule générale des amides N,N-disubstitués :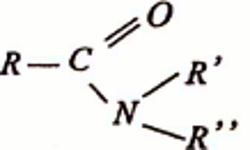 R’ et R’’ sont des groupes carbonés
R’ et R’’ sont des groupes carbonés
5. Deux caractéristiques de la réaction d'estérification entre un acide carboxylique et un alcool : Lente, athermique, réversible ou limitée. 0,5 x 2 = 1 pt
6. Un facteur cinétique et son influence sur la vitesse de formation d'un produit.
• La concentration initiale des réactifs : La vitesse de formation d'un produit augmente avec la concentration initiale des réactifs.
• La température : La vitesse de formation d'un produit augmente avec la température du milieu réactionnel.
• Le catalyseur : Il accélère la vitesse de formation d'un produit lorsqu'il est présent
Exercice 2 : Application des savoirs / 8 pointS
1. Formules semi-développées des composés: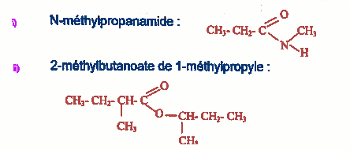 2-1. La nature des corps B et A.
2-1. La nature des corps B et A.
A : Alcool primaire 0,5 pt
B : Aldéhyde 0,5 pt
2-2. Formules semi-développées de A et B si l'oxydation de B donne l'acide 2-méthylpropanoïque.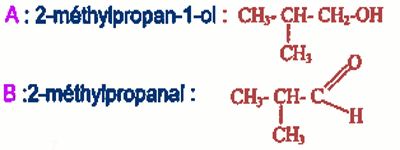 3-Solution d'acide benzoïque \({C_6}{H_5}COOH\) (\(C = {10^{ - 2}}\) mol/L et \(pH = 3,2\) à \(25{}^oC\)).
3-Solution d'acide benzoïque \({C_6}{H_5}COOH\) (\(C = {10^{ - 2}}\) mol/L et \(pH = 3,2\) à \(25{}^oC\)).
3-1- Montrons que l'acide benzoïque est un acide faible.
\(\left[ {{H_3}{O^ + }} \right] = \) \({10^{pH}} = \) \(6,3 \times {10^{ - 4}}\) mol/L or \(C = {10^{ - 2}}\) mol/L
\(\left[ {{H_3}{O^ + }} \right] \prec C\) donc l'acide benzoïque est un acide faible. 1 pt
3.2 Equation-bilan de la réaction avec l’eau
\({C_6}{H_5}COOH + \) \({H_2}O \) \( \to \) \({C_6}{H_5}CO{O^ - } + \) \({H_3}{O^ + }\) 1 pt
3.3 Expression de la constance d’acidité Ka
\(Ka = \) \(\frac{{\left[ {{C_6}{H_5}CO{O^ - }} \right]\left[ {{H_3}{O^ + }} \right]}}{{\left[ {{C_6}{H_5}COOH} \right]}}\) 1 pt
Exercice 3 Utilisation des savoirs / 8 points
1.1 Courbe donnant \(\left[ {{I_2}} \right] = f(t)\) 2 pts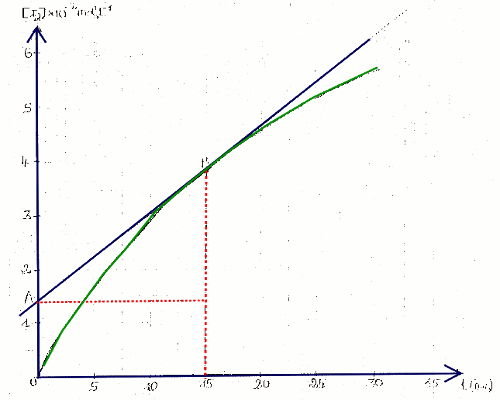 1.2 Vitesse formation de \({{I_2}}\) à \(t = 15\) min
1.2 Vitesse formation de \({{I_2}}\) à \(t = 15\) min
Détermination graphique ( voir image plus haut)
En traçant la tangente a la courbe a \(t = 15\) min, on trouve la pente qui est \(V\left( {{I_2}} \right)\) ainsi :
\(V\left( {{I_2}} \right) = \) \(\frac{{\left( {3,85 - 1,4} \right) \times {{10}^{ - 2}}}}{{\left( {15 - 0} \right)}}\) \( = 1,6 \times {10^{ - 2}}\) mol/L.min 2 pts
1.3 Relation entre la vitesse de formation de \({{I_2}}\) et la vitesse de disparition de \({I^ - }\)
D’après l’équation-bilan de la réactions
\(\frac{{V{{\left( {{I^ - }} \right)}_t}}}{2} = \) \(\frac{{V{{\left( {{I_2}} \right)}_t}}}{1} \Rightarrow \) \(V{\left( {{I^ - }} \right)_t} = \) \(2V{\left( {{I_2}} \right)_t}\) 1 pt
AN : \(V{\left( {{I^ - }} \right)_t} = \) \(2 \times 1,6 \times {10^{ - 3}} = \) \(3,2 \times {10^{ - 3}}\) mol/L.min 1 pt
2. La vitesse de formation du diiode diminue au cours du temps. 1pt
3- Justification de cette opération. 1pt
Cette opération appelée trempe, permet de bloquer ou stopper la réaction afin de doser le diiode présent.
Partie B : Évaluation des Compétences / 16 points
1- Protocole permettant d’aboutir au point de demi-équivalence
Dosage pH-métrique d'une solution d'acide faible All par une base l'une \(H{O^ - }\)
♦ Après avoir rincé la verrerie,
♦ Introduire un volume Va de la solution d'acide faible dans un bûcher ;
♦Introduire la solution de base forte dans la burette graduée jusqu'à la graduation zéro (0);
♦Plonger les électrodes du pH-mètre préalablement étalonné dans le bécher:
♦ Mettre en marche l’agitateur magnétique ;
♦ Verser progressivement la solution de base forte dans le bécher ;
♦ Noter chaque fois la valeur du pH indiquée par le pH-mètre correspondant au volume de base versé ;
A l'aide des résultats obtenus, tracer la courbe \(pH = f(Vb)\) ;
♦ Déterminer le volume à l'équivalence \(V{b_E}\); par la méthode des tangentes parallèles ;
♦ Calculer le volume a la demi-équivalence \(Vb\left( {\frac{1}{2}eq} \right) = \frac{{V{b_{eq}}}}{2}\) de base à verser
♦ Reprendre le dosage en laissant couler un volume \(\frac{{V{b_{eq}}}}{2}\) de la solution de base forte dans le bécher contenant le volume Va initial de la solution d'acide faible et lire le pH correspondant au mélange obtenu. 1,5 pt
Dispositif expérimental.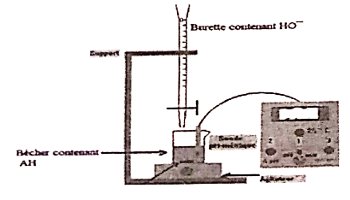 2- Le problème posé : Préparation d'une solution tampon de \(pH = 9,2\)
2- Le problème posé : Préparation d'une solution tampon de \(pH = 9,2\)
\(pH = pKa + \) \(\log \frac{{\left[ {N{H_3}} \right]}}{{\left[ {NH_4^ + } \right]}}\) \( = 9,2 = \) \(pKa\left( {NH_4^ + /N{H_3}} \right)\) 0,5 pt
1| faut que \({\left[ {NH_4^ + } \right] = \left[ {N{H_3}} \right]}\) pour avoir \(pH = pKa\).
N'ayant pas les ions \({NH_4^ + }\) en solution, il faut les produire en faisant réagir \({N{H_3}}\) avec \({H_3}{O^ + }\). suivant l'équation de la réaction :
\(N{H_3} + {H_3}{O^ + }\) \( \to NH_4^ + + \) \({H_2}O\) 0,5 pt
Réactif à choisir : Ammoniac et acide chlorhydrique.
Il faut doser l’ammoniac par l'acide chlorhydrique jusqu'à la demi- équivalence 1,5 pt
Calcul des volumes l'acide et de base à prélever
A la demi-l’équivalence, on a :
\({n_{{H_3}{O^ + }}} = \frac{{{n_{N{H_3}}}}}{2}\) \( \Rightarrow {C_1}{V_1} = \) \(\frac{{{C_2}{V_2}}}{2}\) 1 pt
Alors \(\left\{ \begin{array}{l}{V_1} + {V_2} = 150\\{V_1} = \frac{{{V_2}}}{2}\end{array} \right.\)
Car, ces solutions ont une même concentration
On trouve \({V_1} = 50\) mL et \({V_2} = 100\) mL 1 pt
Pour répondre au besoin de la commande, ATEBA doit :
Réaliser dans un bécher un mélange 50 mL de solution d’acide chlorhydrique et 100 mL de solution d'ammoniac. 1 pt
Ou bien il doit introduire 100 mL de solution d’ammoniac dans un bécher puis à l’aide d'une burette laisser couler 50 mL de solution d'acide chlorhydrique. 1 pt
Le mode de préparation de la solution tampon commandé peut être acheminé au principal du collège Bilingue les COMPÉTENTS 1 pt
Commentaires
Enregistrer un commentaire