ENNONCE
Exercice 1 CHIMIE ORGANIQUE /6pts
1.1- QCM: Relever le numéro de la seule réponse juste de celles proposées par question. 0,25pt x 3
1 1.1) Un alcool est un composé organique dans lequel un groupe hydroxyle —OH est lié à :
a) Un carbone trigonal b) un carbone tétragonal; c) Un carbone digonal; d) Un atome d'azote saturé.
1 1.2) Deux stéréo-isomères diffèrent par:
a) leurs formules développées; b) leurs formules semi-développées; c) leurs fonctions chimiques; d) la disposition spatiale des atomes.
1 1 3- Un acide α-aminé de configuration D :
a) est nécessairement dextrogyre ; b) est nécessairement lévogyre ; c) peut être dextrogyre ou lévogyre.
1 2. D'une substance naturelle, trois composés organiques A, B et D ont été isolés, analysés et identifiés:
A = CH3-CH2-CH(CH3)-CH(C2H5)-CH(C2H5)-NH-C2H5 ,
B= CH3-CH2-CH(C2H5)-CO-O-CH(CH3)-CH(CH3)2
D = acide 2-amino-3-hydroxybutanoique.
1 2 1- Étude du composé A
1 2 1 1- Choisir, parmi les noms suivants celui/ceux qui convient(ent) à A: (0,25ptx2)
a) N-éthyl-4-éthyl-5-méthylheptan-3-amine ; b) N-éthyl-1,2-dléthyl-3-méthyipentylamine ; c) N-éthyI-tiv-éthyl-5-méthylheptylamine.
1 2 1 2- Le composé A est une amine secondaire qu'on notera par la suite R—NH-C2H5. Dans un mélange de A et du chloroéthane CH3CH2-Cl en excès, il se produit une série de réactions dont le produit final est un sel d'ammonium quaternaire A’.
a) Écrire la formule semi-développée du composé A’ et le nommer. (0,25+0,25)pt
b) L'ensemble des réactions aboutissant au sel A‘ met en jeu le caractère basique et le caractère nucléophile des amines.
Donner la cause de ce double caractère. (0,25pt)
1 2 2- Le composé B est un ester qu'on peut obtenir par action d'un alcool B1 sur un acide B2 (méthode 1) ou sur B’; le chlorure de cet acide (méthode 2).
1 2 2 1-Écrire la formule semi-développée et le nom des composés B1, B’2 et B1. (0,25x2)ptx3
1 2 2 2-Donner, en justifiant, la méthode de synthèse avantageuse des deux proposées 0,25 ptx2
1 2 2 3- L'acide B2 peut être obtenu par oxydation ménagée du composé B"2 de formule C6H12O.
Donner la fonction chimique, la formule semi-développée et le nom de B"2. 0,75pt
1 2 3. Le composé D (acide 2- amino-5-hydroxybutanoique) est un acide α-aminé.
1 2 3 1- Écrire la formule semi-développée de D. (0,25pt)
1 2 3 2- Justifier l'appellation «acide α-aminé» donnée à D. (0,25x2)pt
1 2 3 3- En dissolvant D dans de l'eau pure, on obtient une solution où D existe sous forme d'un ion hybride D’ appelé amphion.
a) Écrire la formule semi-développée de l'ion D’. (0,25pt)
b) Écrire les équations de réaction avec l'eau de cet ion traduisant son caractère amphotère, en précisant le rôle joué par l'ion dans chaque cas. (0,25+0,25)ptx2
Exercice 2 : ACIDES ET BASES / 6 POINTS
Les questions 2 1-, 2 2- et 2 3- sont indépendantes.
2 1- Définir, illustrant par un exemple, une base forte selon Brônsted. (0,5pt)
2 2- Dans une solution aqueuse S, à la température θ, le rapport : \(\frac{{[{H_3}{O^ + }]}}{{[H{O^ - }]}} = {4.10^{ - 6}}\)
2 2 1- Donner en justifiant la nature acido-basique de la solution S. (0,25x2)pt
2 2 2- La mesure du pH de cette solution donne pH=10.
Calculer la valeur du produit ionique de l'eau Ke à cette température. (0,5)
2 3- On travaille maintenant à 25oC
La mesure du pH d'une solution de chlorure d'ammonium NH4CI de concentration C = 0,10 moL/L donne un pH = 5,1.
2 3 1- Dire, en justifiant, si l'ion ammonium \(NH_4^ + \) est un acide faible ou fort. 0,5pt
2 3 2- Écrire l'équation de la réaction de cet ion avec l'eau puis donner l'expression de la constante d'acidité Ka du couple correspondant (0,25+0,25) pt
2 3 3- On dissout 53,5mg de chlorure d'ammonium dans une solution Sb., d'ammoniac NH3 et on complète le volume à 1 L Le mélange obtenu a un pH =10,2.
2 3 3 1- Faire l'inventaire des espèces chimiques présentes dans le mélange et calculer leurs concentrations. On donne Ka = 6,31.10-10. (1,5 pt)
2 3 3 2- En déduire no(NH3) la quantité initiale d'ammoniac contenu dans la solution Sb. 0,5pt
2 3 3 3- IL faut un volume Va=12,0 mL de solution d'acide chlorhydrique molaire (1 mol/L) pour doser tout l'ammoniac de la solution Sb, Montrer que ce résultat est en accord avec celui de la question 2 3 3 2-. (0,75pt)
2 3 4- Pour préparer un volume V =100 mL de solution tampon de pH = 9,4, on mélange un volume V. de solution d'ammoniac de concentration Cb= 0,10 moL/L et un volume Va de solution de chlorure d'ammonium de concentration Ca= 0,10 mol/L. Calculer Vb, et Va (0,75 pt)
On donne, en g/mol, les masses molaires atomiques suivantes : N:14 ; Cl: 35,5 ; H: 1 .
Exercice 3 : CHIMIE GÉNÉRALE / 4 Points
3 1- Cinétique chimique / 2 pts
Dans une solution d'acide chlorhydrique de concentration C = 0,10 moL/L, on ajoute en excès de la poudre de magnésium Mg. Il se produit dans ce mélange la réaction chimique d'équation bilan suivante :
\(Mg + 2{H_3}{O^ + }\)\( \to M{g^{2 + }} + {H_2}\)\( + 2{H_2}O\)
Pour suivre l'évolution de la réaction, on mesure le pH de la solution en fonction du temps.
3 1 1- Montrer que la concentration molaire des ions magnésium formés à chaque instant est :
\([M{g^{2 + }}](t) = \frac{1}{2}(C - {10^{ - PH}})\). (0,5pt)
3 1 2- Calculer la vitesse volumique v12 de formation des ions magnésium entre t1=3 min et t2 =7 min sachant que pH1 =1,6 et pH2 = 2,4. (0,5pt)
3 1 3- On donne la courbe de formation des ions magnésium suivant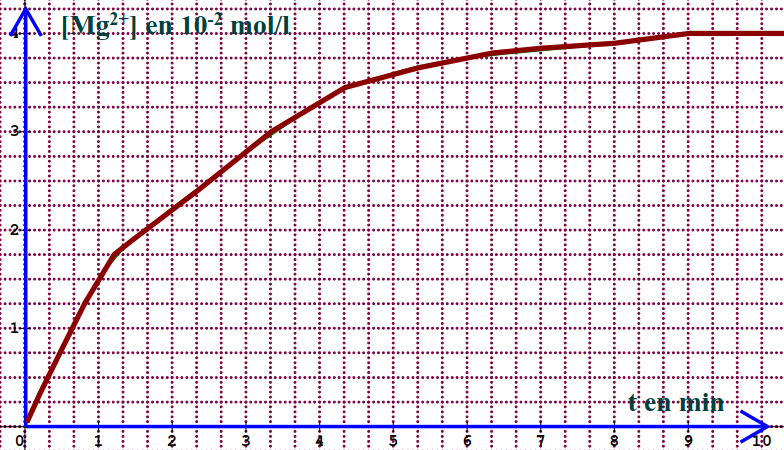
3 1 3 1- Définir : temps de demi réaction notée \({t_{\frac{1}{2}}}\); (0,25pt)
3.1 3 2- Déterminer le temps de demi-réaction \({t_{\frac{1}{2}}}\) de cette réaction. (0,25pt)
3 1 3 3- À une date t’ donnée, la vitesse de formation des ions magnésium est v'=5,8.10-3moL/L.min. En déduire la vitesse volumique de disparition des ions H3O+.(0,5pt)
3 2- Niveaux d'énergie atomique / 2 pts
3 2 1 Comparer, aspect et en longueur d'onde, le spectre d’émission d’un atome et son spectre d’absorption. (0,5pt)
3.2.2 Application : Le Spectre d'émission d'un atome \({}_ZX\) a un fond obscur et présente deux raies brillantes aux longueurs \(\lambda \) et \(\lambda '\),‘ Décrire le spectre d'absorption de cet atome. (0,5pt) –
3 2 3- On donne ci-dessus le diagramme énergétique de cet atome (schéma pas à l'échelle).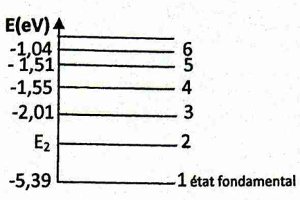
3 2 3 1- Définir une transition électronique. (0,25pt)
3 2 3 2- De l'état fondamental, quand cet atome absorbe un photon de longueur d'onde \(\lambda = 672nm\), il passe au niveau d'énergie 2 d'énergie E2.
Calculer, en eV, la valeur de E2. (0,5pt)
3. 2 3 3- L'énergie du niveau n de l'atome d'hydrogène est donnée par la formule
\({E_n} = - \frac{{13,6}}{{{n^2}}}(eV)\)
\({}_ZX\) peut-il être l'atome d'hydrogène? justifier la réponse. (0,25pt)
Données : h (constante de Planck) = 6,63.10-34 J.s ; c = 3,0x108 m/s ; 1 eV= 1,6x10-19J.
Exercice 4 : EXPÉRIENCE DE CHIMIE / 4 POINTS
Détermination du degré d de pureté d'un échantillon de « bicarbonate de soude» officinal. Le « bicarbonate de soude» officinal, utilisé en cas d'acidité excessive de l'estomac, est l’hydrogénocarbonate de sodium de formule NaHCO3. Par définition \(d = \frac{m}{{100}}\) , m étant la masse, en gramme, de NaHCO3 pur contenue dans 100g d'échantillon officinal. On introduit 0,8g de « bicarbonate de soude» officinal dans une fiole jaugée de 100mL et on complète jusqu'au trait de jauge avec de l'eau distillée. On prélève ensuite un volume Vb=20 mL de .cette solution et on suit avec un pH-mètre l'évolution du pH lors de l'addition progressive d'une solution d'acide chlorhydrique de concentration Ca = 0,10 mol/L, La réaction de dosage a pour équation bilan suivante:
\(HCO_3^ - + {H_3}{O^ + }\) \( \to C{O_2} + 2{H_2}O\)
On trace ensuite la courbe de variation du pH en fonction du volume Va de solution d'acide chlorhydrique versé, Va. en mL,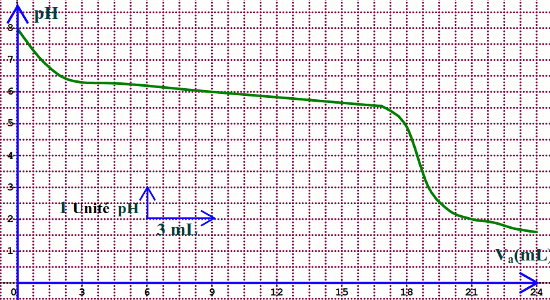 4 1- Faire un schéma annoté du dispositif expérimental. (1pt)
4 1- Faire un schéma annoté du dispositif expérimental. (1pt)
4 2- Déterminer graphiquement :
4.2.1- les coordonnées du point équivalent E, à savoir VaE et pHE; (0,5pt)
4.2.2- si \(HCO_3^ - \) est une base faible ou forte, en précisant deux arguments justiflcatifs;(0,75pt)
4.2.3- le pKa du couple \(HCO_3^ - /C{O_2}\). (0,5pt)
4 3- Calculer le nombre de mole d’hydrogénocarbonate de sodium pur contenu dans l'échantillon de masse 0,8 g. (0,75pt)
En déduire d le degré de pureté du « bicarbonate de soude» officinal. (0,5pt)
On donne M(g/mol) : C: 12 ; O: 16; H: 1; Na: 23
CORRECTION
Exercice 1 : Chimie organique
1.1 Questions à choix multiples (0,25x3=0,75 pt)
1.1.1 b)
1.1.2 d)
1.1.3 c)
1.2.1 Etude du composé A
1.2.1.1 : Les noms a) et b) conviennent à A (0,25x3=0,75 pt)
1.2.1.1.2. a) Formule semi-développée de A’ (0,5pt)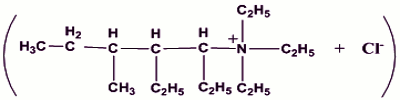 Nom : Chlorure de triéthyl1-2-diéthyl-3-méthylpenthylammonium
Nom : Chlorure de triéthyl1-2-diéthyl-3-méthylpenthylammonium
b) La cause du double caractère basique et nucléophile des amines est due à la présence du doublet non liant sur l’atome d’azote (0,25pt)
1.2.2.1 Formules semi-développées et noms de B1, B’2 et B2 (0,25x6=1,5 pt)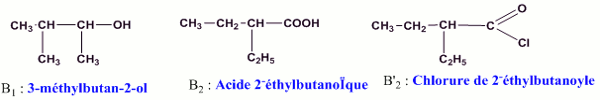 1.2.2.2 Méthode de synthèse le plus avantageuse : c’est la méthode 2 car avec B’2 la réaction d’estérification est rapide et totale
1.2.2.2 Méthode de synthèse le plus avantageuse : c’est la méthode 2 car avec B’2 la réaction d’estérification est rapide et totale
1.2.2.3 Formule chimique, formule développées et nom de B’’2
B’’2 : Fonction chimique : Fonction aldéhyde
Formule semi-développée et nom de B’’2 (0,75 pt)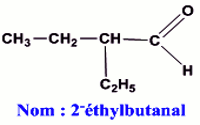 Nom : 2-éthylbutanal
Nom : 2-éthylbutanal
1.2.3.1 Formule semi-développée de D (0,25 pt)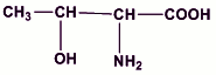 1.2.3.2 Justification de l’appellation « acide α–aminé » : les fonctions acide carboxylique et amine présentes dans la molécule sont portées par le même atome de carbone (0,25 pt)
1.2.3.2 Justification de l’appellation « acide α–aminé » : les fonctions acide carboxylique et amine présentes dans la molécule sont portées par le même atome de carbone (0,25 pt)
1.2.3.3 a) Formule semi-développées de l’ion D’ (0,25 pt)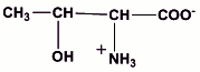 b) Mise en évidence du caractère amphotère
b) Mise en évidence du caractère amphotère
- Caractère basique (0,25 pt)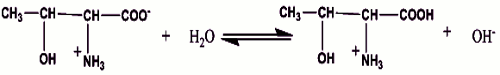 D’ Joue le rôle de base (0,25 pt)
D’ Joue le rôle de base (0,25 pt)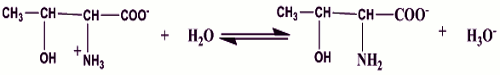 D’ Joue le rôle d’acide
D’ Joue le rôle d’acide
Exercice 2 :Acide base
2.1Base forte selon Bronsted : espèce chimique susceptible de capter un ou plusieurs protons au cours d’une transformation chimique. (0,25 pt)
Illustration par un exemple : cas de l’ion hydroxyde HO- (0,25pt)
\(H{O^ - } + {H^ + } \to {H_2}O\)
2.2.1 Nature acido-basique de la solution S en justifiant : (0,5 pt)
\(\frac{{\left[ {{H_3}{O^ + }} \right]}}{{\left[ {H{O^ - }} \right]}} \prec 1\) alors \(\left[ {{H_3}{O^ + }} \right] \prec \left[ {H{O^ - }} \right]\) ; la solution est basique
2.2.2 Calcule du produit ionique de l’eau à cette température (0,5 pt)
\(Ke = \left[ {{H_3}{O^ + }} \right].\left[ {H{O^ - }} \right]\) \( = \left[ {{H_3}{O^ + }} \right].\frac{{\left[ {{H_3}{O^ + }} \right]}}{{{{4.10}^{ - 6}}}}\) \( = \frac{{{{\left[ {{H_3}{O^ + }} \right]}^2}}}{{{{4.10}^{ - 6}}}}\) or \(\left[ {{H_3}{O^ + }} \right] = {10^{ - PH}}\) \( = {10^{ - 10}}\)
\(Ke = \frac{{{{10}^{ - 20}}}}{{{{4.10}^{ - 6}}}}\)
AN : \(Ke = {2,5.10^{ - 15}}\)
2.3.1 Justifions si \(NH_4^ + \) est acide fort ou un acide faible (0,5 pt)
\( - \log c = 1\) et \(pH = 5,1\), \(pH \succ - \log C\) donc \(NH_4^ + \) est acide faible
2.3.2 Equation de la réaction avec l’eau (0,25 pt)
\(NH_4^ + + {H_2}O\) \( \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} N{H_3} + {H_3}{O^ + }\)
Expression de la constance d’acidité Ka (0,25 pt)
\(Ka = \frac{{\left[ {N{H_3}} \right]\left[ {{H_3}{O^ + }} \right]}}{{\left[ {NH_4^ + } \right]}}\)
2.3.3.1 Inventaire des espèces chimiques et calcule des concentrations (0,25x5=1,25 pt)
- Espèces chimiques \(NH_4^ + \), \({H_2}O\), \(N{H_3}\), \({H_3}{O^ + }\), \(O{H^ - }\), \(C{l^ - }\)
- Calcule des concentrations
\(\left[ {{H_3}{O^ + }} \right] = {10^{ - pH}}\) \( = {10^{ - 10,2}} = \) \(6,31 \times {10^{ - 11}}\) mol/l
\(\left[ {O{H^ - }} \right] = \frac{{{{10}^{ - 14}}}}{{{{10}^{ - 10,2}}}}\) \( = {10^{ - 3,8}} = \) \(1,58 \times {10^{ - 4}}\) mol/l
\(\left[ {C{l^ - }} \right] = \frac{m}{{MV}}\) \( = \frac{{53,5 \times {{10}^{ - 3}}}}{{53,3 \times 1}}\) \( = {10^{ - 3}}\)
\(\left[ {NH_4^ + } \right] = \left[ {C{l^ - }} \right]\) \( + \left[ {O{H^ - }} \right] - \left[ {{H_3}{O^ + }} \right]\) \( \approx \left[ {C{l^ - }} \right] + \left[ {O{H^ - }} \right]\) \( = {10^{ - 3}} + 1,58 \times {10^{ - 4}}\) donc
\(\left[ {NH_4^ + } \right] = 1,16 \times {10^{ - 3}}\) mol/l
\(\left[ {N{H_3}} \right] = \) \(\frac{{Ka\left[ {NH_4^ + } \right]}}{{\left[ {{H_3}{O^ + }} \right]}} = \) \(1,16 \times {10^{ - 2}}\) mol/l
2.3.3.2 Nombre de mole de \({n_o}(N{H_3})\) dans la solution Sb(0,5 pt)
\(Co(N{H_3}) + Co(NH_4^ + )\) \( = \left[ {NH_4^ + } \right] + \left[ {N{H_3}} \right]\)
\(Co(N{H_3}) = \left[ {NH_4^ + } \right]\) \( + \left[ {N{H_3}} \right] - \frac{m}{{MV}}\)
\({n_o}(N{H_3}) = \) \(\left( {\left[ {NH_4^ + } \right] + \left[ {N{H_3}} \right] - \frac{m}{{MV}}} \right)V\)
\({n_o}(N{H_3}) = \) \(1,18 \times {10^{ - 2}}\) mol
2.3.3.3 Calcule de la quantité d’ammoniac n (0,5 pt)
À l’équivalence \(n = CaVa\), \(n = 1,2 \times {10^{ - 2}}) mol
\({n_0} \approx n\), ce resultat est en accord avec celui de 2.3.3.2 (0,25 pt)
2.3.4 Calcule Va et Vb(0,75 pt)
\(pKa = - \log Ka\) \( = - \log (6,31 \times {10^{ - 10}})\) \( = 9,2\)
\(pH = pKa\) \( + \log \left( {\frac{{\left[ {N{H_3}} \right]}}{{\left[ {NH_4^ + } \right]}}} \right)\) or \(\left[ {N{H_3}} \right] = \frac{{CbVb}}{{Va + Vb}}\) et \(\left[ {NH_4^ + } \right] = \frac{{CaVa}}{{Va + Vb}}\)
\(pH = pKa\) \( + \log \left( {\frac{{CbVb}}{{CaVa}}} \right)\) or \({Ca = Cb}\)
\(\log \left( {\frac{{Vb}}{{Va}}} \right) = pH\) \( - pKa = 0,2\) d’où les équations suivantes
\(\frac{{Vb}}{{Va}} = {10^{0,2}}(1)\) et \({Va + Vb = V(2)}\)
Après résolution de ce système, nous avons :
\({Va = 38,7}\) mL et \({Vb = 61,3}\) mL
Exercice 3 :Chimie générale
3.1 Cinétique chimique
3.1.1 Montrons que : (0,5 pt)
\(\left[ {M{g^{2 + }}} \right] = \frac{1}{2}\left( {C - {{10}^{ - pH}}} \right)\)
Le bilan molaire nous permet d’avoir :
\(\frac{{{n_{{H_3}{O^ + }(réagit)}}}}{2} = \frac{{{n_{M{g^{2 + }}(formé)}}}}{1}\)
\({n_{{H_3}{O^ + }(réagit)}} = \) \({n_{{H_3}{O^ + }(initial)}} - \) \({n_{{H_3}{O^ + }(restant)}}\)
\({n_{M{g^{2 + }}}} = \) \(\frac{1}{2}({n_{{H_3}{O^ + }(initial)}} - \) \({n_{{H_3}{O^ + }(restant)}})\)
En divisant cette relation membre à membre par le volume du mélange, on obtient :
\(\left[ {M{g^{2 + }}} \right] = \frac{1}{2}\left( {C - {{10}^{ - pH}}} \right)\)
3.1.2 Calcule de la vitesse volumique de formation de Mg 2+
\({V_{12}} = \frac{{\Delta \left[ {M{g^{2 + }}} \right]}}{{\Delta t}} = \) \(\frac{{\left[ {M{g^{2 + }}} \right]{t_2} - \left[ {M{g^{2 + }}} \right]{t_1}}}{{{t_2} - {t_1}}}\) \( = \frac{{{{10}^{ - p{H_1}}} - {{10}^{ - p{H_2}}}}}{{2{{\left( {{t_2} – t_1} \right)}}}}\)
\({V_{12}} = \frac{{{{10}^{ - 1,6}} - {{10}^{ - 2,4}}}}{8}\) \( = 2,64 \times {10^{ - 3}}\) mol/l.min
3.1.3.1Temps de demi-réaction t1/2 : c’est le temps au bout duquel la moitié de la quantité initiale de réactif limitant a réagit (0,25 pt)
3.1.3.2 Détermination de t1/2 (0,25 pt)
À partir de la courbe, nous avons la concentration finale en ion Mg2+ est 4 10-2 mol/L, au temps de demi-réaction, la concentration en ion Mg2+ est 2 10 -2 mol/L qui correspond à t=t1/2=2,5 min
3.1.3.3. Vitesse de disparation des ions H3O+
\(\frac{{{n_{{H_3}{O^ + }}}}}{2} = {n_{M{g^{2 + }}}}\) \( \Rightarrow {v_{{H_3}{O^ + }}} = 2{v_{M{g^{2 + }}}}\)
\({v_{{H_3}{O^ + }}} = 1,16 \times {10^{ - 2}}\) mol/L.min
3.2 Niveau d’énergie atomique
3.2.1 Comparaison entre aspect et longueur d’onde des spectres d’émission et d’absorption (0,5 pt)
Les deux spectres de raies sont complémentaires en aspect et identique en longueur d’onde
3.2.2 Description du spectre d’absorption de l’atome
Le spectre d’absorption a un fond brillant et présente deux raies sombres aux longueur d’ onde \(\lambda \) et \(\lambda '\)
3.2.3.1 La transition électronique est le passage d’un atome d’un niveau d’énergie à un autre (0,25 pt)
3.2.3.2 Calcule de E2 (0,5 pt)
\(\Delta E = \frac{{hC}}{\lambda }\) \( \Rightarrow {E_2} - {E_1}\) \( = \frac{{hC}}{\lambda }\)
\({E_2} = - 5,66 \times {10^{ - 19}}J\)
\({E_2} = - 5,39eV\)
3.2.3.3\({}_ZX\) n’est pas l’atome d’hydrogène car l’énergie de son état fondamental est différente de -13,6 eV (0,25 pt)
Exercice 4 :Expérience de chimie
4.1 Schéma annoté du dispositif expérimental (0,25x4=1pt)
Schema dispositif experiemental
4.2.1 Coordonnées du point d’équivalence déterminées graphiquement : (0,5 pt)
\(Vae = 18,6\) mL et \(p{H_E} = 3,8\)
4.2.2\(HCO_3^ - \) est une base faible : (0,5 pt)
- La courbe présente deux points d’inflexion (0,5 pt)
- Le saut de pH est peu élevé (0,5 pt)
4.2.3 pKa de \(HCO_3^ - /C{O_2}\) (0,5 pt)
\(pKa = \) \(p{H_{\frac{1}{2}E}}\left( {{V_{\frac{1}{2}E}} = \frac{{VaE}}{2}} \right)\)
Graphiquement, pKa=6
4.3 Calcule du nombre de mole ne d’hydrogénocarbonate de sodium pur contenu dans l’échantillon de masse 0,8 g (0,5 pt)
Soit n’b le nombre de mole de NaHCO3 contenu dans 20 mL de solution à doser :
À l’équivalence, \(n{'_b} = {n_a} = {C_a}{V_{aE}}\)
\(n{'_b} = 1,86 \times {10^{ - 3}}\) mol
Dans 100 mL de solution, le nombre de mole de NaHCO3 est :
\({n_e} = 5n{'_b} = 19,3 \times {10^{ - 3}}\) mol
Déduction du degré de pureté (0,75pt)
Soit me la masse de NaHCO3 contenue dans l’échantillon de masse 0,8g
\({m_e} = {n_e}M\) \( = 5.n{'_b}.M\)
Pour l’échantillon de 100g, nous avons : \({m_e} = \frac{{100{n_e}M}}{{0,8}}\)
Le degré de pureté est donc
\(d = \frac{{{m_e}}}{{100}} = \) \(\frac{{{n_e}M}}{{0,8}} = 0,976\)
\(d = 97,6\% \)
- Obtenir le lien
- X
- Autres applications
- Obtenir le lien
- X
- Autres applications
Commentaires
Enregistrer un commentaire